Chemie für die Methanol-Wirtschaft
Weil die Preise von Erdöl instabil und seine Ressourcen begrenzt sind, werden Petrochemikalien zunehmend aus Methanol hergestellt – vor allem in China. Chemiker der ETH Zürich haben nun die ersten Schritte dieses Umwandlungsprozesses entschlüsselt.
Es ist die weltweit am häufigsten produzierte Grundchemikalie: Ethen – ein kleines Molekül bestehend aus zwei Kohlenstoffatomen und vier Wasserstoffatomen. Es ist ein Grundbaustein für eine grosse Palette an Polymeren und Weichmachern. Der weitverbreitete Verpackungskunststoff Polyethylen (PE) ist nur einer davon. Während Ethen heute vor allem durch sogenanntes Cracken von Erdöl hergestellt wird, nimmt mit den stets stark schwankenden Preisen und den endlichen Reserven von Erdöl ein alternativer Herstellungsweg stark an Bedeutung: dessen Synthese aus Methanol. Bekannt ist dieser Syntheseschritt unter dem englischen Namen «Methanol-to-olefins» (MTO). Wissenschaftler der ETH Zürich und der ENS Lyon haben nun im Detail aufgeklärt, wie diese Reaktion beginnt.
Chemiker entwickelten den MTO-Prozess in den späten 1970er-Jahren, heute stehen Produktionsanlagen weltweit. Nirgends jedoch gibt es so viele davon wie in China: Fünf Grossanlagen sind dort in Betrieb, dreizehn weitere in Planung. Denn China hat einen riesigen Bedarf an Petrochemikalien, jedoch kein Erdöl. Allerdings hat das Land Kohlereserven, und über die Vergasung von Kohle kann auf einfache Weise Methanol hergestellt werden. Ausserdem lässt sich Methanol aus Erdgas herstellen. Chinesische Investoren planen daher, in den USA aus dem dort in Fülle vorhandenen Schiefergas Methanol für den Export nach China herzustellen.
Woher stammt das notwendige Carbenium-Ion?
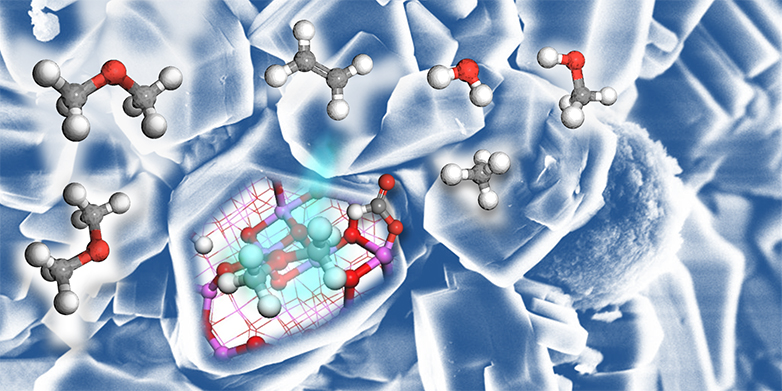
Damit die MTO-Reaktion überhaupt stattfindet, werden dem Methanol bei 400 Grad Celsius sogenannte Zeolithe als Katalysator beigemischt. Das sind poröse Aluminiumsilikat-Körner. Lange Zeit konnten Wissenschaftler den chemischen Mechanismus der MTO-Reaktion nicht genau erklären. Und vor 20 Jahren postulierten Chemiker, dass ein weitere Moleküle im Spiel sein müssen: ringförmige, positiv geladene Kohlenwasserstoff-Moleküle, in denen fünf bis sechs Kohlenstoffatome miteinander verbunden sind. Es sind diese Carbenium-Ionen genannten Moleküle, welche eigentlich mit Methanol reagieren: Sie fügen zwei Methanol-Moleküle zusammen und stellen eine chemische Bindung zwischen zwei Kohlenstoffatomen her, womit Ethen entsteht.
Nur: Wie gelangen diese Carbenium-Ionen ins Reaktionsgemisch? Wissenschaftler stellten schon früh die Hypothese auf, dass das Methanol damit verunreinigt sein könnte und diese Verunreinigung eine Voraussetzung dafür ist, dass die Reaktion überhaupt starten kann.
Das schweizerisch-französische Forscherteam schlägt nun eine andere Erklärung vor. «Wir konnten zeigen, dass Aluminumoxid, welches auch in den Zeolith-Katalysatoren vorhanden ist, Methanol in Ethen und andere Kohlenwasserstoffe umsetzen kann. Diese wiederum können in den Poren der Zeolithe in Carbenium-Ionen umgewandelt werden», erklärt Christophe Copéret, Professor für Oberflächen- und Grenzflächenchemie an der ETH Zürich und einer der Autoren der Studie. «Während die MTO-Reaktion bereits sehr gut im industriellen Massstab läuft, erklären wir nun, wie sie zum Laufen kommt. Unsere Arbeit zeigt ausserdem, dass einfache Oxide wie Aluminumoxid die Verbindung von zwei Kohlenstoffatomen auslösen kann. Damit werden nun auch neue Wege denkbar für die Umwandlung von Methanol-Abkömmlingen in längerkettige Kohlenwasserstoffe.»
Literaturhinweis
Comas-Vives A, Valla M, Copéret C, Sautet P: Cooperativity between Al Sites Promotes Hydrogen Transfer and Carbon–Carbon Bond Formation upon Dimethyl Ether Activation on Alumina. ACS Central Science, 5. August 2015, doi: externe Seite10.1021/acscentsci.5b00226call_made